В настоящее время известны 18 разновидностей водного льда, из них 15 кристаллические и 3 аморфные (не имеющие упорядоченной внутренней структуры). Модификации различаются структурой кристаллической решетки и физическими свойствами (плотностью, электрической проводимостью, температурой).
Рисунок 1. Лед.
Аморфный лед мог бы утонуть в воде, но этого не происходит, потому что при нагревании он сразу же превращается в обычный кристаллический лед и всплывает. Чтобы получить аморфный лед, нужно охлаждать воду с огромной скоростью, такой, чтобы молекулы не успели построить кристаллическую решетку.
Рисунок 2. Текстура льда
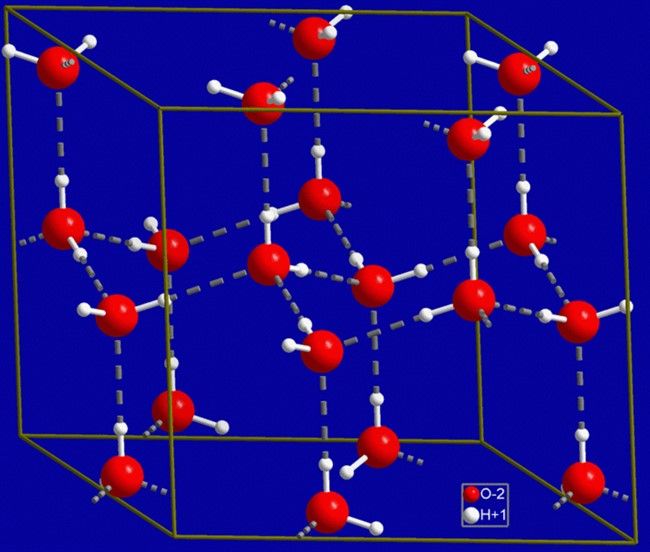
На Земле можно обнаружить только лед Ih, в котором каждая молекула воды окружена четырьмя другими, расположенными на одинаковом расстоянии от нее. Такая структура делает лед менее плотным, чем вода. Именно поэтому при понижении температуры водоемы замерзают не полностью, а лишь покрываются слоем льда.
Рисунок 3. Структура обычного льда Ih
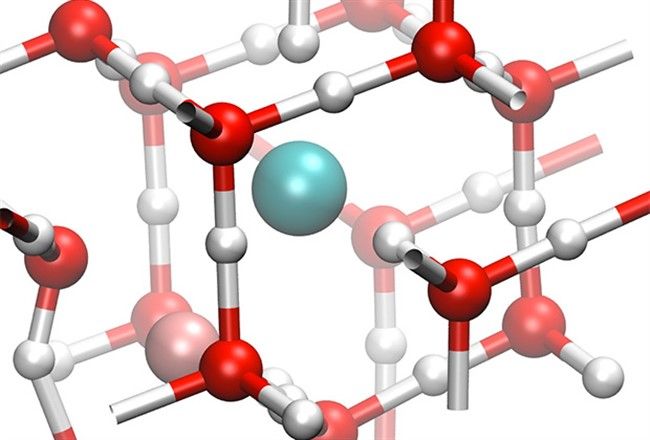
В атмосфере изредка встречается лед Iс, кристаллическая решетка которого аналогична решетке алмаза. Эта модификация может существовать только при температуре ниже −73 °C. Остальные формы льда получены в лаборатории либо обнаружены в космосе.
Рисунок 4. Структура Льда
Лед отражает 45% падающего света, а снег – 95%. Покрытая ими поверхность Земли получает тепла на 65% меньше нормы, что оказывает большое влияние на климат. Летом полярные широты получают больше солнечного излучения, чем экваториальные, но температура остается низкой, потому что значительная часть тепла затрачивается на таяние льда.
Рисунок 5. Ледяные горы
Лед обычно содержит значительно меньше примесей, чем вода: даже на грязной луже ледяная корка будет чистой и прозрачной. Это происходит из-за того, что в процессе замерзания в первую очередь строится кристаллическая решетка из молекул воды, а примеси скапливаются на границе с жидкой фазой. А вот лед II нестабилен в чистом виде: его получают в лаборатории только в присутствии гелия.
Рисунок 6. Лед Байкала
При нормальных условиях вода начинает превращаться в лед при температуре 0°C. Микроскопические возмущения (обычно это частицы примесей) становятся центрами кристаллизации, вокруг которых и происходит процесс замерзания.
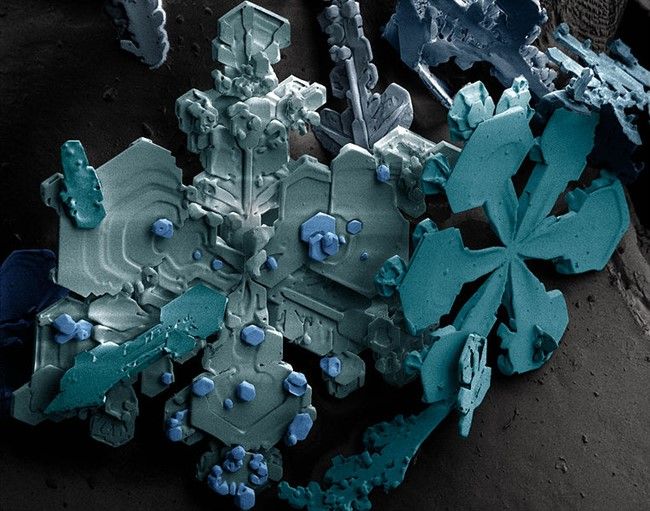
Рисунок 7. Снежинки, увеличенные при помощи сканирующего электронного микроскопа.
Если устранить возмущения, можно получить переохлажденную воду, которая будет замерзать при −43 °C. Производители напитков начали использовать этот эффект в коммерческих целях: в Великобритании и Сингапуре можно найти специальные автоматы с переохлажденной газировкой. Когда бутылку с напитком открывают, в ней появляются центры кристаллизации, что приводит к моментальному образованию льда.
Другие статьи по теме "Занимательная физика":
- Интересные факты о молниях
- Самые редкие и красивые облака
- Что будет, если подводная лодка будет двигаться со скоростью света?
- Почему горячая вода замерзает быстрее, чем холодная?
- Самые ценные и редкие вещества на Земле
- Парадоксы в физике: кот Шредингера